Gases; proceso isotérmico; y proceso isobárico
Gases:
Sustancia que ocupa la totalidad del volumen del recipiente que lo contiene , y que esta conformada con partículas(moléculas) con movimientos en todas las direcciones y choques al azar.
No tiene forma.
Disminuir su volumen.
Relación entre la masa de una sustancia y
su volumen.
Cuando dos gases se mezclan y las
partículas quedan repartidas.
Se mezclan completa y uniformemente,
Cantidad de materia (moles)
Fuerza por unidad de área.
Espacio en el cual se mueven las
partículas.
Grado de movimiento de las partículas.
“Proceso isotérmico”
En este proceso la temperatura permanece constante. Como la energía interna de una gas ideal sólo es función de la temperatura, en un proceso isotérmico de un gas ideal la variación de la energía interna es cero (∆U= 0) La curva hiperbólica se conoce como isotérmica. Q = W Estos son los procesos en los cuales antes, durante y después la temperatura es constante.
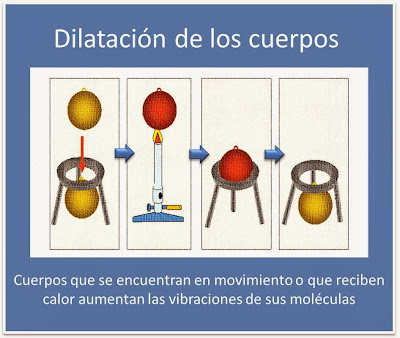
“Proceso isobárico”



Comentarios
Publicar un comentario