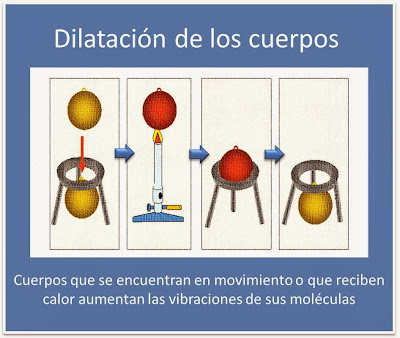
CALOR, CANTIDAD DE CALOR
Termodinámica




La termodinámica se ocupa del
estudio de las relaciones que se establecen entre el calor y el resto de las
formas de energía. Entre otras cuestiones la termodinámica se ocupa de analizar
los efectos que producen los cambios de magnitudes tales como: la temperatura,
la densidad, la presión, la masa, el volumen, en los sistemas y a un nivel
macroscópico.

CALOR
La física entiende el calor
como la energía que se traspasa de un sistema a otro o de un cuerpo a otro, una
transferencia vinculada al movimiento de moléculas, átomos y otras partículas.
Calor
es el proceso de intercambio de energía térmica que se transfiere entre dos
sistemas (o un sistema y sus alrededores) debido a una diferencia de
temperatura.
También se denomina calor a la
energía en tránsito que se reconoce solo cuando se cruza la frontera de un
sistema termodinámico. Una vez dentro del sistema, o en los alrededores, si la
transferencia es de dentro hacia afuera, el calor transferido se vuelve parte
de la energía interna del sistema o de los alrededores, según su caso.
El término calor, por tanto,
se debe de entender como transferencia
de calor y solo ocurre cuando hay diferencia de temperatura y en dirección de
mayor a menor. De ello se deduce que
no hay transferencia de calor entre dos sistemas que se encuentran a la misma
temperatura (están en equilibrio térmico).
CANTIDAD DE CALOR
Cantidad de calor (Q).- Se
llama así, a la cantidad de calor que gana o pierde un cuerpo o sustancia al
ponerse en contacto con otro cuerpo que se encuentra a diferente temperatura,
cuya ecuación está dado por:
Siendo Ce. el calor
especifico, "m" la masa y T, T0 las temperaturas inicial y final.
Cuando, T >T0, el cuerpo
gana calor
La unidad de Q esta dado en
calorías.
Calor especifíco
Cantidad de calor necesaria para que una masa de 1 gr eleve su temperatura a 1 ºC.
Se representa con la c minúscula.
c= C/ m
Capacidad calorifíca
Cantidad de calor necesaria para que la masa completa de una sustancia
eleve su temperatura.
Se representa con la C mayúscula.
C= Q/ (Tf-Ti)
Calor latente
Es la cantidad de calor que necesita una sustancia para pasar del estado
sólido a líquido (calor de fusión). O de
líquido a gas (calor de evaporización).
Sin cambios de temperatura.
Q= m.
L
Q= Cantidad de calor
m= a la masa de la sustancia.
L= al calor latente
Comentarios
Publicar un comentario